乙烯是高中化学有机物中的常客,是最具代表性的烯烃。它的结构简单,具有烯烃的一般性质,是初学者认识烯烃这类物质的敲门砖。下面就让小编给大家讲一讲考试时实验题目中,容易考到的制取乙烯的三种方法,当然仅仅局限于理论(考试)之上,是满满的知识干货,不具有实际操作性。

液加热法制取乙烯
-
1
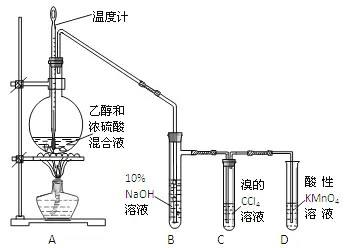
液加热法,也即分解乙醇法,是实验室制取乙烯的常用方法。使用乙醇(CH3CH2OH)在170摄氏度的高温下加入浓硫酸(H2SO4),使其分解为乙烯(CH2=CH2)和水(H2O),从而制取乙烯。

-
2
在该反应中,浓硫酸充当了催化剂与脱水剂。反应时注意乙醇与浓硫酸应按1:3的体积分数混合。
-
3
考试时若问及防止暴沸的方法,我们可答:在加热乙醇的装置内加入适量碎瓷片。
END
裂解法制取乙烯
-
1
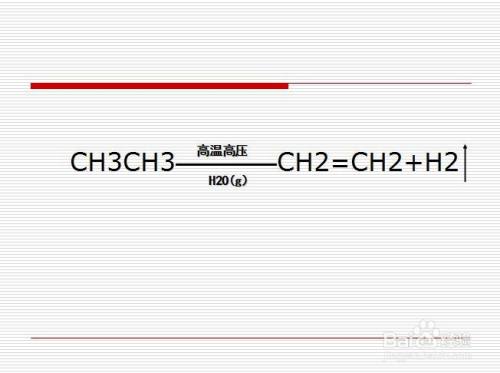
乙烷(CH3CH3)是一类烷烃,可通过石油分馏得到,乙烷裂解可生成乙烯(CH2=CH2)与氢气(H2)。
-
2
在实际生产中,为了促进该反应发生,需要高温高压的条件,必要时可向其中通入水蒸气以降低压强,促使反应向右移动。这里可能会牵扯到平衡移动的考点。
END
卤代烃法制取乙烯
-
1
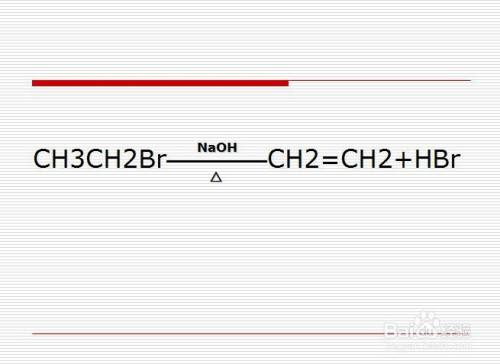
溴乙烷(CH3CH2Br)是常见的卤代烃之一。其在烧碱(NaOH)与乙醇(CH3CH2OH)溶液中加热可生成乙烯(CH2=CH2)与氢溴酸(HBr)。
-
2
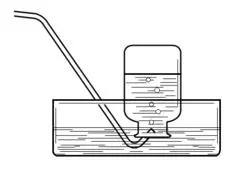
注意乙烯(CH2=CH2)在加热条件下易蒸发成气体逸出,故需要安排收集气体的装置,比如使用排水法收集。
 END
END
经验内容仅供参考,如果您需解决具体问题(尤其法律、医学等领域),建议您详细咨询相关领域专业人士。
作者声明:本篇经验系本人依照真实经历原创,未经许可,谢绝转载。
展开阅读全部
文章评论