化学反应原理是高考中学生必争的得分项目。因为化学反应原理的知识点相对于必修一、必修二是比较少的。如果学生掌握了,往往此处很容易得高分。
方法/步骤
-
1
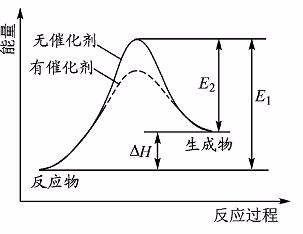
有效碰撞是那些本身具有较高能量的分子之间的碰撞。能够发生有效碰撞的分子叫做活化分子。把活化分子比普通分子多出来的能量叫活化能。

-
2
计算反应热的两种方法。(1)通过反应物体系能量与生成物体系能量之差(2)通断键(吸热)和成键(放热)之差。

-
3
催化剂是改变反应速率。是“改变”,所以既可以指加快反应速率,也可以指减慢反应速率。
-
4
化学反应过程中,不仅有物质的变化,同时还伴随着能量的变化,以热能、电能或光能等形式表现出来。注意:大多数情况是以热能形式,但不是只能以热能形式表现。

-
5
常见的放热反应:燃烧反应、酸碱中和反应、金属与酸的置换反应。大部分的化合反应。
-
6
常见的吸热反应:氢气还原三氧化钨来制钨,大部分的分解反应。
-
7
陷阱:溶解时会吸热或放热。但这些都不是吸热反应或放热反应,因为它们不是化学反应,只能说吸热或放热。
 END
END
注意事项
-
图片来自网络,如有不妥,请联系作者,立马改正。
经验内容仅供参考,如果您需解决具体问题(尤其法律、医学等领域),建议您详细咨询相关领域专业人士。
作者声明:本篇经验系本人依照真实经历原创,未经许可,谢绝转载。
展开阅读全部
文章评论