微粒半径的比较,是高考化学的热点,对学生来说,亦是个难点.
方法/步骤
-
1
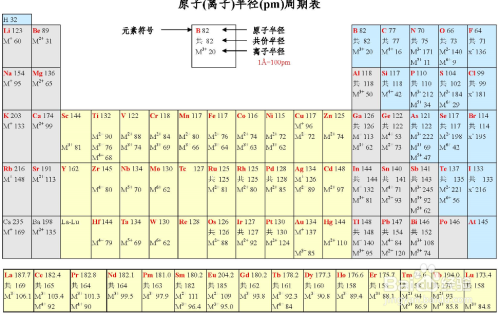
根据元素在元素周期表中的位置来判断:
同层核大半径小;同族核大半径大
.比如:Na>Mg K>Na
-
2
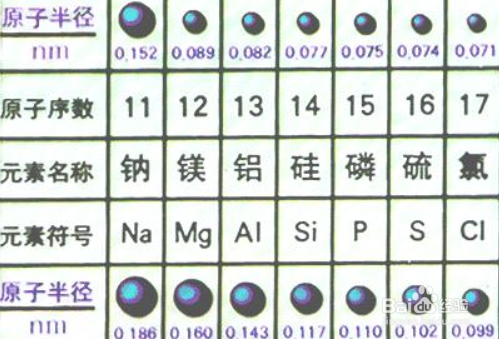
对于其他微粒:阳离子、阴离子来说,我们可以按照一下的顺序来比较:
1、电子层数多,半径大.可以这样理解,电子在原子核外按层排布,类似于洋葱,皮(层)多,洋葱(原子)的半径自然就大.
-
3
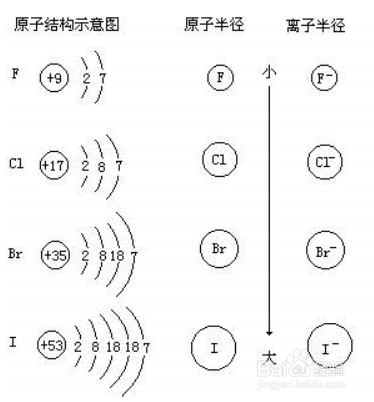
2、电子层数相同,则比较核电荷数,核电荷多,则半径小.
可以理解为:电子层相同时,核电荷越多,原子核对核外电子的吸引力越大,原子核将电子的距离拉的更小!
-
4
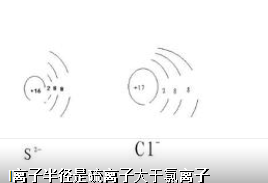
3、电子层数相同,则比较电子数,电子数多,半径大(直观感觉:多"吃"了一个包子,就长胖了,也就是粗了一圈)
 END
END
例题练习
-
1
Al和O比较大小:Al有三个电子层,O有两个电子层,所以Al>O
-
2
Al 3+ 和F-比较大小:电子层都是2,又因为Al的核电荷(序数)大于F,所以Al3+>F-
-
3
Na 和Na+比较大小:它们的电子层数和核电荷数都相同,
但是Na+比Na少了一个电子,所以Na>Na+
同理:Cl- >Cl
END
经验内容仅供参考,如果您需解决具体问题(尤其法律、医学等领域),建议您详细咨询相关领域专业人士。
作者声明:本篇经验系本人依照真实经历原创,未经许可,谢绝转载。
展开阅读全部
文章评论